España, a la cola de los grandes mercados europeos en acceso a medicamentos oncológicos y huérfanos.
Falta de Medicamentos: En España está disponible el 61% de los antiecológicos aprobados en los últimos años, frente al 100% en Alemania, el 90% en Italia y el 80% en Francia.
La innovación
La innovación más puntera en el ámbito de los medicamentos no está a disposición de los especialistas y los pacientes españoles, ni en número ni en plazos, como lo está en los países de nuestro entorno, una desventaja aún mayor cuando se trata de fármacos huérfanos y del ámbito oncológico. Del total de 160 moléculas que han recibido una aprobación centralizada en la Unión Europea entre 2017 y 2020 -y tras la observación de las incorporaciones en los distintos mercados a lo largo de todo 2021-, solo 85 (el 53%) han llegado al mercado español a 31 de diciembre de 2021, y la situación es similar con los medicamentos oncológicos, de los que han llegado a España 25 de 41 aprobados en la UE (el 61%), y huérfanos, de los que disponemos de 25 de los 57 aprobados, es decir el 44%.
Empeora año a año
Además, este agravio comparativo empeora año a año. Así, el informe anual de Indicadores de acceso a terapias innovadoras en Europa (W.A.I.T. Indicator por sus siglas en inglés), elaborado por la consultora Iqvia para la Federación Europea de Asociaciones de la Industria Farmacéutica (Efpia), arroja los citados datos en su edición de este año, y en ediciones anteriores reveló que en 2020 llegaron al mercado español el 54% del total de medicamentos aprobados; el 58%, en 2019, y el 62%, en 2020.
También son significativos los plazos para la introducción de los nuevos compuestos en el mercado español. El tiempo medio que transcurre desde que un nuevo medicamento es aprobado por las autoridades europeas hasta que está disponible para su uso en España era de 517 días a finales de 2021 -más de 17 meses de demora – frente a los 133 días de Alemania, 240 de Francia y 340 de Inglaterra. Y este retraso también es cada año mayor: al finalizar 2020, el plazo medio era de 453 días; en 2019, era de 414 días, y de 385 días en 2018.
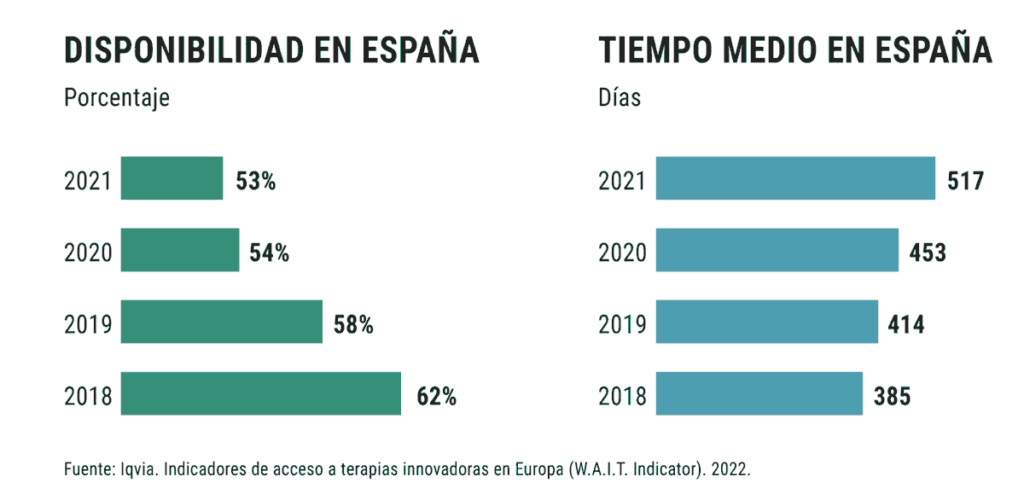
Y la situación aún es más llamativa en la comparativa con el resto de los países incluidos en el análisis; 39 en total, de los que 27 son miembros de la UE y otros 12 no lo son. El porcentaje de fármacos disponibles en España del total de los aprobados entre 2017 y 2020 es también el más bajo de los grandes mercados europeos. Según el informe, frente al 53% del total de aprobados en el citado periodo que habían recibido el visto bueno en España a 31 de diciembre de 2021, en Alemania este porcentaje es del 92%; en Italia, del 79%; en Inglaterra, del 68%, y en Francia, del 66%. Desde 2018, el porcentaje de disponibilidad en España ha disminuido en nueve puntos porcentuales.
España tiene también la mayor tasa de disponibilidad restringida entre los principales mercados, con un 41%. Es decir, del 53% de los medicamentos disponibles sobre el total de autorizados en Europa, cuatro de cada diez lo están en nuestro país con algún tipo de restricción a las indicaciones aprobadas en la UE. Ese porcentaje es del 1% en Alemania, del 13% en Italia, del 15% en Francia y del 39% en Inglaterra.
Peor en Oncología
Y la situación se agrava si se pone el foco en los medicamentos del área oncológica, ámbito en el que, tal como recuerda Ramón García Sanz, jefe del Laboratorio de Histocompatibilidad del Servicio de Hematología y Hemoterapia del Complejo Asistencial de Salamanca, y presidente de la Sociedad Española de Hematología y Hemoterapia (SEHH), “los pacientes de otros países que tienen acceso a estos fármacos viven, y los de aquí, que no lo tienen, se mueren”.
Según el informe, el tiempo medio en 2021 para acceder a los nuevos medicamentos oncológicos ha aumentado en 74 días respecto a 2018, y la demora ya alcanza los 469 días. Además, el porcentaje de disponibilidad de los tratamientos oncológicos aprobados en Europa entre 2017 y 2020 es en España del 61% (están disponibles 25 de los 41 fármacos oncológicos autorizados en este periodo), y es la cifra más baja de los países de nuestro entorno. Así, la disponibilidad en Alemania es del cien por cien; en Italia, del 90%; en Inglaterra, del 85%, y en Francia, del 80%.
España ocupa el puesto número 18 entre los 39 países incluidos en el informe en cuanto a número de medicamentos oncológicos introducidos en el mercado en ese periodo. Con más compuestos incorporados en sus respectivos mercados están no solo los que serían comparables a España, sino también otros como Escocia (con 30), Grecia y Portugal (ambos con 29), la República Checa (27) y Eslovenia (26).
Países como Grecia, la República Checa o Eslovenia no solo acceden a un número mayor de anticancerígenos que España, sino que la disponibilidad en esos países es mucho menos restringida, ya que solo el 15% de los medicamentos frente al cáncer que se introdujeron en la República Checa tienen alguna restricción de las indicaciones, y el 12% entre los aprobados en Eslovenia, mientras que en España el 40% de los 25 introducidos en el periodo estudiado tienen alguna limitación en sus indicaciones.
En Alemania, Países Bajos, Bélgica y Noruega, no hay restricción alguna en las indicaciones de los anticancerígenos que llegan al mercado.
Razones para la restricción
Las restricciones que frenan o limitan el acceso a algunos medicamentos en España son, en ocasiones, “curiosas”, según García Sanz, y a veces incluso “están por encima de los criterios de inclusión de los compuestos en los ensayos clínicos”.
En su opinión, “el mejor informe de posicionamiento es el EPAR (European Public Assessment Report)”, en el que se basa la evaluación de medicamentos para su posterior autorización en la EMA. Y el empeoramiento de los últimos años en el acceso a los medicamentos oncológicos responde, según el presidente de la SEHH, “a la falta de profesionalidad en algunos niveles del Ministerio de Sanidad”.
En España, la incorporación de medicamentos a la cartera del SNS depende de la Dirección General de Cartera Común de Servicios del Sistema Nacional de Salud y Farmacia del Ministerio de Sanidad, que se basa para ello en los Informes de Posicionamiento Terapéutico (IPT).
Retraso medio de 18 meses
“La situación es penosa; un retraso medio de 18 meses es una auténtica barbaridad” afirma el hematólogo
Un ejemplo es el compuesto daunorubicina/citarabina liposomal, recién incorporado al mercado español para la leucemia mieloide aguda, y aprobado por la EMA en agosto de 2018. El compuesto duplica la mediana de supervivencia a los dos años de seguimiento. “La ventaja para los pacientes españoles con esta patología en estos tres años y medio ha sido nula”.
Entre los medicamentos para algún tipo de cáncer que, de momento, quedan fuera del mercado español, hay ejemplos especialmente relevantes. “Alguno de ellos son los inhibidores del BRAF, que son activos en una pequeña proporción de pacientes con cáncer de colon. Están financiados en la mayoría de los países europeos.
Sin embargo, a pesar del importante impacto que tienen en supervivencia, y de disponer de la máxima catalogación en la escala de beneficio clínico de la ESMO para tratamientos paliativos, en España no están financiados”, afirma Rafael López, presidente de la Fundación ECO y jefe del Servicio de Oncología Médica del Complejo Hospitalario Universitario de Santiago de Compostela.
“Otro ejemplo –añade López- son los inhibidores o fármacos que actúan contra el NTRK, indicados en tumores que tienen una serie de alteraciones que afectan a una minoría de pacientes, incluidos pacientes pediátricos. Estos fármacos tienen una excelente respuesta y un incremento importantísimo en la supervivencia, y tampoco están financiados en nuestro país –sí en muchos otros países europeos-, o tienen la resolución de no financiación, de una forma incomprensible porque, aunque el número de pacientes que hay son muy pocos, para ellos estos fármacos cambian completamente el pronóstico de una forma impactante”.
Valorar el acceso a la Innovación
El oncólogo afirma que “los profesionales, y los pacientes, que realmente son a los que debemos servir, valoramos el acceso a la innovación, y, sobre todo, el acceso rápido a la innovación, como una altísima prioridad porque el paciente con cáncer no suele tener una segunda oportunidad. Retrasos en el acceso provocan una importante pérdida de oportunidad en los pacientes con cáncer.
Es cierto que los fármacos y la innovación cuestan, y que los sistemas públicos tienen que velar por un sistema equilibrado, sostenible y justo, pero en situaciones tan dramáticas como un cáncer avanzado, o ante la posibilidad de curarse con un tratamiento adyuvante, creo que debe primar la innovación sobre la economía”.
El especialista del hospital de Santiago considera que las autoridades sanitarias españolas son conscientes de la situación. No obstante, “no están cercanas a los pacientes, porque no son quienes los ven, ni a las situaciones comprometidas que se están viendo en las consultas día a día, y eso les hace ser menos sensibles a la situación de una enfermedad en progresión para la que puede existir un tratamiento paliativo que mejora de una forma importante, como la mayoría de los tratamientos que aprueba la EMA, y a los que no se tiene acceso”.
“Sin duda –continúa López-, es necesario incorporar en las tomas de decisiones a personal independiente y técnico, como clínicos, y también pacientes, como se hace en otros sistemas europeos de acceso. El trabajo conjunto y multidisciplinar es imprescindible para este tipo de visiones y decisiones que afectan a toda la sociedad y, especialmente, a los pacientes”
Coincide García Sanz, y añade que se debería evaluar el resultado de los medicamentos en paciente en vida real, así como confiar en los aspectos científicos de los fármacos, de manera que, “si producen una mejora significativa se debe asumir el coste de su introducción en el mercado y, si no se introducen, se debe asumir el coste de no hacerlo”. Y, por último, “trabajar con las farmacéuticas para que ajusten al máximo los costes y beneficios de los medicamentos”.
En España, los precios ya son inferiores a los de otros países, pero esto también entraña un riesgo de desequilibrio que puede llevar a que las compañías renuncien al mercado español, y entonces los pacientes españoles no tendrán forma de acceder a esos medicamentos”.
Desventaja, también en huérfanos
Y la situación no es mejor en el caso de los medicamentos huérfanos, para los que el tiempo medio en 2021 para acceder a ellos en España ha aumentado en 184 días respecto al informe de 2018 y se sitúa en los 696 días, lo que supone casi dos años de retraso; en Alemania, el tiempo medio de acceso a los huérfanos aprobados en la UE es de 102 días. Además, sólo el 44% (25 de 57) de estos tratamientos autorizados en Europa en los últimos cuatro años están disponibles en España.
Es el porcentaje más bajo de los países de referencia: Alemania tiene el 95%; Italia, el 75%; Francia, el 72%, e Inglaterra, el 61%, y por delante de España en el acceso a estos productos, nuevamente, vuelven a estar países como Países Bajos o Portugal, que acceden al 55% y 51%, respectivamente.
La Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (Aelmhu) tiene su propio informe, que también revela un acceso desigual, pues recoge que sólo el 43% de los 129 medicamentos huérfanos con autorización de la EMA son accesibles en países como Rumanía y España, frente a Alemania, que comercializa prácticamente el cien por cien de los autorizados por la EMA, seguido de Países Bajos, Finlandia e incluso Portugal. “En los últimos años, hemos pasado de ninguna a más de 200 nuevas terapias para las enfermedades raras”, apunta Juan Carrión, presidente de la Federación Española de Enfermedades Raras (Feder).
“Frente a ello –añade Carrión-, “es necesario alinear los criterios de evaluación y acceso a medicamentos entre los diferentes países y las comunidades autónomas, ya que existen diferentes fórmulas de acceso a medicamentos de alto impacto, donde a las dificultades de comercialización nacionales se suma que cada autonomía tiene una política diferente al respecto”.
Diario Médico
Cristina G. Real
Madrid

También te puede interesar este artículo.
Falta de equidad en el Tratamiento del Mieloma Múltiple (Carta a la Ministra de Sanidad).



